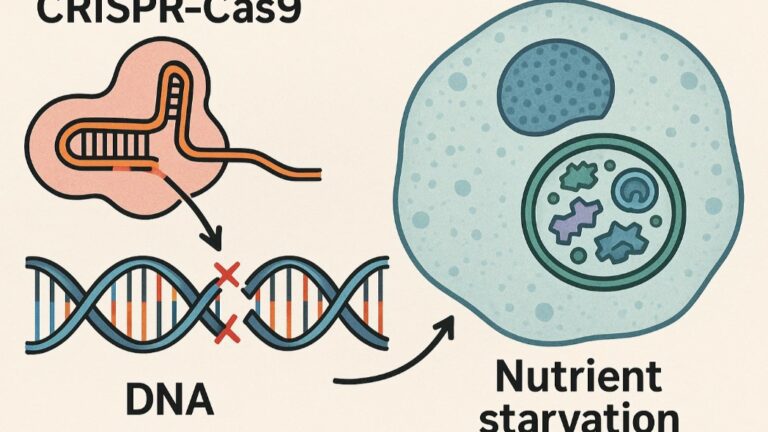
유전자 교정 기술, 특히 CRISPR-Cas9은 2010년대 후반부터 생명과학의 신기원을 연 기술로 평가받는다. 하지만 여전히 가장 큰 한계점 중 하나는 ‘치명적 오교정(Mis-editing)’이다. 비표적 영역을 잘못 편집하거나, DNA 절단 후 이어붙이는 과정에서 오류가 발생하는 문제다.
이에 KAIST와 한국생명공학연구원(KRIBB) 공동연구팀은 정면돌파 전략을 택했다. 바로 ‘세포를 굶기는’ 것이다. 세포에 에너지 결핍 상태를 유도하면 일종의 생존 전략으로 자가포식이 활성화된다. 이 때 세포는 손상된 구성 요소를 제거하고, 유전자 손상 역시 더 정교하게 복구하는 능력을 발휘한다.
🔍 기술적 배경: DNA 복구 경로와 정밀편집
CRISPR-Cas9은 DNA의 특정 부위를 자르고, 이후 세포 자체의 DNA 복구 메커니즘에 의해 잘린 부위를 복구하면서 유전자 교정이 이뤄지는 방식이다. 세포의 복구 경로는 크게 두 가지다:
1. 비상동 말단 연결(NHEJ): 빠르긴 하지만 부정확.
2. 상동 재조합(HDR): 느리지만 정확한 복구 가능.
연구진은 세포에 단기적인 영양 결핍을 유도해 자가포식을 일으킨 결과, HDR 빈도가 NHEJ에 비해 눈에 띄게 증가했음을 발견했다. 이는 세포가 DNA 복구시 보다 정확한 경로를 선택했다는 것을 의미하며, 유전자 교정 기술의 ‘정밀도’를 비약적으로 향상시킬 수 있다는 뜻이다.
📈 연구의 의의: 유전자 치료의 안전성 강화
이번 기술은 특히 질병 치료를 위한 유전자 편집에서 활용도가 높다. 예를 들어, 유전적 결함을 수정하기 위한 치료 유전자 삽입 과정 등에서 잘못된 편집이 발생하면 돌이킬 수 없는 결과로 이어질 수 있다. 실제로 지난 수년간 일부 유전자 치료 사례에서 예기치 못한 오작동이 보고되기도 했다.
자가포식 기반 정밀유도 기술은 이러한 위험요소를 크게 줄이며, 동시에 특정 조직 내에서만 효율적인 유전자 교정이 가능하도록 정제된 타깃 전략까지 실현 가능성을 열어준다.
💡 전문가 분석 & 전망
분자유전학자 박희정 교수(서울대학교 생명과학부)는 “이번 성과는 단지 정확도 향상뿐 아니라, 유전자 교정의 시공간적 조절 가능성을 연 기술”이라고 평가했다.
하지만 그는 “자가포식은 세포 스트레스 반응의 일종이기에, 만성적 자극이 오히려 세포 생존에 악영향을 줄 가능성도 배제할 수 없다”고 경고했다. 다시 말해 ‘선택적으로’, ‘일시적으로’ 굶기는 기술적 절묘함이 병행돼야 한다는 의미다.
🔎 향후 과제 및 응용 가능성
– 암세포 표적 치료: SIRT1, mTOR과 같은 자가포식 제어 경로를 활용해 종양세포만 조준 가능성 존재
– 근감소증 치료: 특정 유전자 회로를 교정해 근육의 재생 능력 조절 가능
– 신경퇴행질환 협응 치료: 자가포식 촉진제를 통한 신경세포 회복 가능성
또한, 이번 기술은 기존 유전자 가위 외에 합성생물학, 시냅스 조절 유전자(editome neurons), CAR-T세포 조작 등 다방면의 바이오 기술과 융합 가능성이 있다.
📝 기자의 시선: “세포를 설득하다”
과학은 더 강한 무기를 만드는 것뿐 아니라, 상대(이 경우 세포)의 행동 원리를 이해하고 그것을 ‘설득’하는 과정이다. 이번 연구는 세포에게 ‘더 정확하게 복구하라’는 주문을, 스스로의 생존전략을 통해 유도해낸 점에서 탁월하다. 유전자 치료의 미래는 칼처럼 자르되, 붓처럼 그리는 정교함을 요구하고 있으며, 한국 연구진이 그 초입에서 의미 있는 발자국을 남긴 셈이다.
전 세계적으로 유전자 편집 기술은 미국과 중국의 주도 하에 급격히 팽창 중이다. 이번 성과가 글로벌 경쟁 구도 속에서 한국 바이오 기술의 정교함과 지속가능성을 보여주는 발표로 이어지기를 기대한다.
참고자료:
– doi:10.xxxx/autophagy-enhanced-crispr-2024
– 생명공학연구원 발표자료
– KAIST 공식 보도자료
답글 남기기